一�、背景
2015年執行新國標�����,許多行業排放標準COD<80mg/L�,生物處理難以達到��,出水溶解性COD在130 – 170 mg/L左右��。2018年以來,各地政府為了貫徹“水十條”精神����,嚴控排污����,紛紛將城鎮污水處理廠排放要求提高到IV水標準�。故深度處理是形勢所迫���,研討相適應的深度處理技術十分必要。
二�、臭氧應用于深度處理的優勢
對比— Fenton法產泥量大���、鹽度大
●形成FeOOH沉淀��,產泥量應在400g/M3,是城市污水廠的三倍!且無熱值�。折合水成本:約1.00 元/ M3.水����。
●污泥熱值低�����,焚燒困難�;屬工業廢物���,不能填埋���。
●殘余700mg/L 硫酸根( III級地表水標準是250)不利于水體自凈���。
●發生厭氧���,產生硫化物��,危害極大�!
優勢 — 催化臭氧�����,異相催化��,清潔、綠色
●pH中性條件下,利用鐵的化合物催化�,不使用藥劑���,不產泥���,不殘留鹽�����。
機理 — 產生·OH,徹底氧化有機物
●文獻報道,對于大部分有機物���,O3與·OH��,反應速度差 107 –109 倍����。
條件 — pH 中性�����,FeOOH催化
關于Fe0 ��、Fe2+催化,在深度處理中屬偽命題:Fe2+與O3反應��,不是催化劑����;
pH 中性條件�, Fe3+完全沉淀,而Fe(III)是催化劑��;
與 O3發應的過渡金屬,并不一定都是催化劑:臭氧在氧化很多金屬單質時���,并不產生·OH���。這種情況同樣說明:臭氧存在著不產生·OH的無效分解�;估計熱分解也屬于這種情況�。
高級氧化規律 — Fe2+催化H2O2 ;Fe(III) 催化O3
依據:過程金屬的化合物是臭氧催化劑����。
三��、臭氧氧化的應用
臭氧性質
●易分解:大氣中,20 ~ 30 min��;水體中����,5 ~ 20 min ;且受溫度影響巨大��,100 ℃時���,分解劇烈����。
●易溶解:是O2的 13倍;比重大:是空氣的1.66倍�。
●濃度低:以純氧源臭氧發生器���, O3為 160�����、 O2 為 2100 mg/L���;而大氣中氧氣為310mg/L�����;符合亨利定律。
污水處理中臭氧工藝有以下特點:
水中臭氧濃度低�����,利用率(含無效分解)遠高于氧氣����;充氧理論不適宜描述臭氧傳質;臭氧尾氣處理�����,并非關鍵�����。
臭氧在給水處理領域的應用
●消毒:氧化細胞內酶;破壞DNA���、RNA物質����;透過細胞膜使之發生通透性畸變。
●給水預處理:去除色、嗅��、味。破壞發色基團中不飽和鍵(芳香基或共軛雙鍵),氧化鐵�、錳等顯色離子����;氧化水中還原性物質。
●臭氧-生物活性炭處理:臭氧起破壞大分子和充氧作用,有機物的降解主要是生物活性炭。
臭氧在工業廢水預處理中的應用
●去除酚、氰、硫氰等易氧化的有機物;
●脫色:印染、染料廢水用臭氧氧化法脫色��;
●烯烴氧化:臭氧可破壞 C=C 雙鍵轉變為羰基��。
●局限性:O3 分子態的直接氧化�,產物為小分子羧酸����、酮和醛類等,很難徹底礦化為CO2����、H2O
●O3 預處理參數:停留10- 20min�����;投加量 20- 50mg/L。
四、臭氧形成高級氧化的途徑
臭氧在水中反應途徑
v直接臭氧反應:污染物 + O3 → 產物或中間物
有選擇性����,速度慢���;氧化不徹底��。
v自由基反應:污染物 + ·OH → 產物或中間物
無選擇性����, ·OH ( E0=2.8 V ) 電位高�,反應能力強,速度快�,可引發鏈反應�,使許多有機物徹底降解����。
●文獻:大部分有機物�,兩者反應速度差 107– 109 倍�����。
根據有機物在O3分解產生·OH 作用����,對自由基鏈式反應���,可以分為兩大類:
●促進劑:不與O3反應����,與·OH反應生成自由基;如,甲醇�����、糖類�、甲醛及天然有機物����;
●抑制劑:與·OH反應不產生自由基����,如�,叔丁醇。
●大量實踐表明:生化出水O3直接臭氧氧化�����,COD去除率20%左右�。
O3形成高級氧化法途徑
機理:形成高級氧化機制與H2O2不同,產生·OH途徑(1)堿性條件�;(2)物理誘導�����;(3)催化劑催化。
●堿性條件pH>10下可產生·OH ����。條件是不存在HCO3-/CO32- 平衡的影響���;
●O3-H2O2:極少量H2O2即可大大強化O3在中性條件下產生·OH �����,可形成實用工藝;
●O3-超聲��、 O3-微波:有作用���,但效率很低�����,工程實施難����,意義不大�;
●O3-UV:可誘導持續形成·OH,對生化處理出水,其色度和濁度均很低��,該方法有實用價值。
關于O3-活性炭:活性炭有催化效果,但作用不大。有報道�����,其表面胺基化后�����,催化效果明顯提高���。
O3 高級氧化催化劑
在中性條件下�����,催化O3形成·OH �;
●過渡金屬氧化物和化合物:MnO2�����、TiO2����、 NiO����、CoO ��、Fe2O3��、FeOOH等����,有良好的催化效果�;
●Al2O3為載體:上述金屬化合物負載在Al2O3上,也有少數文獻報道負載單質金屬Cu���、Ni等;
●同相催化:有報道,Fe2+、Mn2+����、Co2+�����、Ni2+等有催化作用��,但效果甚微。
其中價廉、無害的Fe�����、Mn�����、Ti等單質和化合物倍受關注
關于Fe2+的催化:
O3 + Fe2+ → FeO2++ O2
FeO2+ + H2O → Fe3++ •OH + OH-
FeO2+ + Fe2+ + H+→ 2Fe3+ + H2O
●Fe2+參加了反應,不是催化劑�;
●pH中性條件��, Fe3+發生完全沉淀,Fe(III)是催化劑�����。
●同理:Fe(0)在氧化環境中被氧化Fe(III)�。
因此,Fe0 �、Fe2+是催化劑在深度處理實踐中屬偽命題�。
五�、催化臭氧的鐵基催化劑
●Fe常見金屬元素,單質和氧化物�����、水解物無毒無害�����;
●Fe(0) 性能活潑����,表面易形成化合物;其氧化物�����、水解產物在工業界大量存在���。
●雖然Fe2O3和Fe3O4都可以作為催化劑��,但根據異相催化機理:表面羥基是催化O3的主要活性點�����。因此��,鐵的羥基氧化物�,如 FeOOH 催化性能更好��。
某些晶型的羥基化物���,著名的有γ-FeOOH��,有較強的催化O3活性;
發現了更有效鐵基復合催化劑���!
優勢:
●材料同質:Fe(X)/Fe(M)、Fe(X)/Fe(X) �;
●損耗產物Fe(III) 有益無害���,可作為吸附劑����;
●價格低廉�����、來源廣泛���。
1����、一種焙燒改性鐵基催化劑
● 制備方法:鐵礦石球磨�、加木屑無氧焙燒。表面經改性���,生成有催化功能的鐵的氧化物和帶有催化功能的碳基化合物�。
● 特點:有固定形狀����,便于工藝應用�����,催化效果一般���。
發明 授權:“一種工業廢水深度處理的催化臭氧氧化方法”
2����、Fenton法分步沉淀制備鐵基催化劑
●方法:Fenton法氧化后�����,控制不同的pH值����、在適宜溫度下分二步沉淀�,制備出催化劑。
●特點:廢物利用,催化效率一般,制備條件不易控制。
發明 :“污水深度處理芬頓法污泥的資源化利用方法”
3、精細化工業廢渣制備鐵基催化劑
● 制備方法:使用化工廢渣�����,控制pH值�、ORP�����、溫度分布沉淀,提取含有Fe�����、Co等有效成分,制備出催化劑。
● 特點:廢物利用�,催化效率高���;需后續分離單元�����。
發明 :“一種紅土鎳礦中和廢酸后制備臭氧氧化催化劑 γ-FeOOH的方法”
4、合金鋼鐵屑改性制備鐵基催化劑
n 制備方法:選定特定合金鋼,經化學改性,表面形成Fe、Mo����、Ni�、Mn等化合物的催化成份�����。
n 特點:催化效率高�,有利于工程實施���;
上述研究成果—— 已申請 十項�����,授權四項����。
對多種工業廢水的實驗研究結果
改性鐵屑催化臭氧氧化���,對兩種實際煤化工廢水的處理效果工程可達到:
COD去除率60%以上��,出水 COD在 60mg/L以下���;
參數:停留時間 40 - 60min;O3 : COD = (1 ~ 1.2): 1
盡管氧化劑費用會高些��,但避免了大量產泥����。
處理對象為某印染行業生化處理出水,生產性所得運行參數:
進水:COD 130 – 170 mg/L���,
工況1:t = 30 min, O3 :rCOD = 1.0
出水 COD在 60 mg/L以下;
工況2:t = 45 min, O3 :rCOD = 1.2
出水 COD在 50 mg/L以下�����;
產生 TFe約在 20 mg/L左右�����。
應用于精細化工園區深度處理:當水力停留時間為 45min時����,COD去除率在49 – 55%之間�����,達到了預期目的。
綠色工藝,應用價值高��!
六、催化臭氧氧化工藝特點
三相反應:高級氧化發生在催化劑表面���;故要求有一定的水力停留時間和水流紊動強度。
反應器形式:塔式(鋼結構)�,折流式(土建結構)��;
停留時間:20 ~ 180 min,隨水質與前端處理工藝不同變化范圍很大��,由小試決定���;
回流比:塔式可不回流�����,折流式 1 ~ 3倍��;
臭氧需要量: O3 : rCOD = 1.0 ~1.6 ��。
錯誤的說法: O3分子中只含一個活性O ,故質量比為:
O3 : rCOD = 3 : 1
理論與實踐均證明是錯誤的���!
O3 形成·OH 當量:每 3分子的O3可生成 2分子·OH ;
·OH氧化有機物:·OH相當于2O2氧化當量����。
由此:3分子O3相當于4分子O2 氧化當量����,即質量比:
O3 : rCOD = 1.125
上述是 很大的理論比�,與本課題組的實踐很接近。
關于 pH 和堿度影響
● pH 值變化:反應過程中pH值均下降����,原因有二:消耗了OH- ;氧化產生有機酸;這與零價鐵化學還原pH 變化趨勢完全相反�����。
● 初始 pH值影響:資料表明�,CO32-比HCO3-/有更強的捕獲·OH ,而污水中均存在著HCO3-/CO32- 平衡,故一般工業廢水在弱酸性條件下比堿性條件好���。
● 當廢水堿度高,堿度( CaCO3計)比 COD 之值大于10時,催化臭氧氧化的效果受到較大的影響。
● 其它陰離子���,如Cl- 、SO42- 、NO3- 沒有明顯影響�����。
● 水溫影響很大��,尚未做系統研究�����,工程意義不大。
關于 COD與 TOC的去除規律
● 催化氧化過程中�����,COD去除趨勢波動�,而 TOC去除趨勢平穩;
● 催化后,幾乎所有廢水TOC的去除率提高幅度更大��;
● 加·OH抑制劑后���,對 TOC去除率影響更大�。
事實說明:O3直接氧化,更多的是轉化了有機物,徹底氧化有機物的比例較小���;而催化O3氧化�,能去除更多種類的有機物,對保護環境和生態健康有著更重要的意義�。
高級氧化及二次生化性分析
生化降解有機物規律:大分子有機物難降解����,小分子有機物易吸收��、降解���,如:乙酸����、乙醇等;
高級氧化有機物規律:大分子有機物容易氧化����,小分子有機物難以氧化��,如:乙酸、丙酮等;
生化出水中的有機物��,難以生物氧化與還原�,也不再有化學活性較高的官能團,故不太可能氧化的中間產物為毒害有機物。
理論分析:經催化臭氧氧化����,其可生化性得到提高���;二次生化工藝是可行的����。
目前工業園區廢水常見不達標的水質指標有:COD����、總氮(TN)
某工業廢水深度處理高級氧化后���,嘗試生物反硝化�����,結果發現:由于有機物受限���,總氮去除率并不高��,但殘余有機物去除率很高,可達70%左右��。間接證明:“二次生化”可行�!
鐵基催化劑的催化功能
鐵基催化劑不僅能催化O3形成·OH ,且可有效地催化O2 �;
催化后 O2氧化能力大幅提高�,比 O3直接氧化��,COD的去除率還要高�。
鐵基催化劑的填料功能
O3在催化劑表面才能有效分解�����,產生·OH���,比表面積大��,產生·OH量大��;
·OH存活期為納秒級,只能“就近”氧化有機物����,比表面積越大,距離越近。
因此�����,比表面積極大地影響催化臭氧反應���。
總結:鐵基催化劑的優勢
pH 中性條件下�����,利用鐵的羥基氧化物催化����,不使用藥劑,不增加鹽度�,臭氧徹底分解�����;
優勢 — 異相催化,不產生污泥�,沒有二次污染���;
特征 — 清潔���、綠色�����、高效。
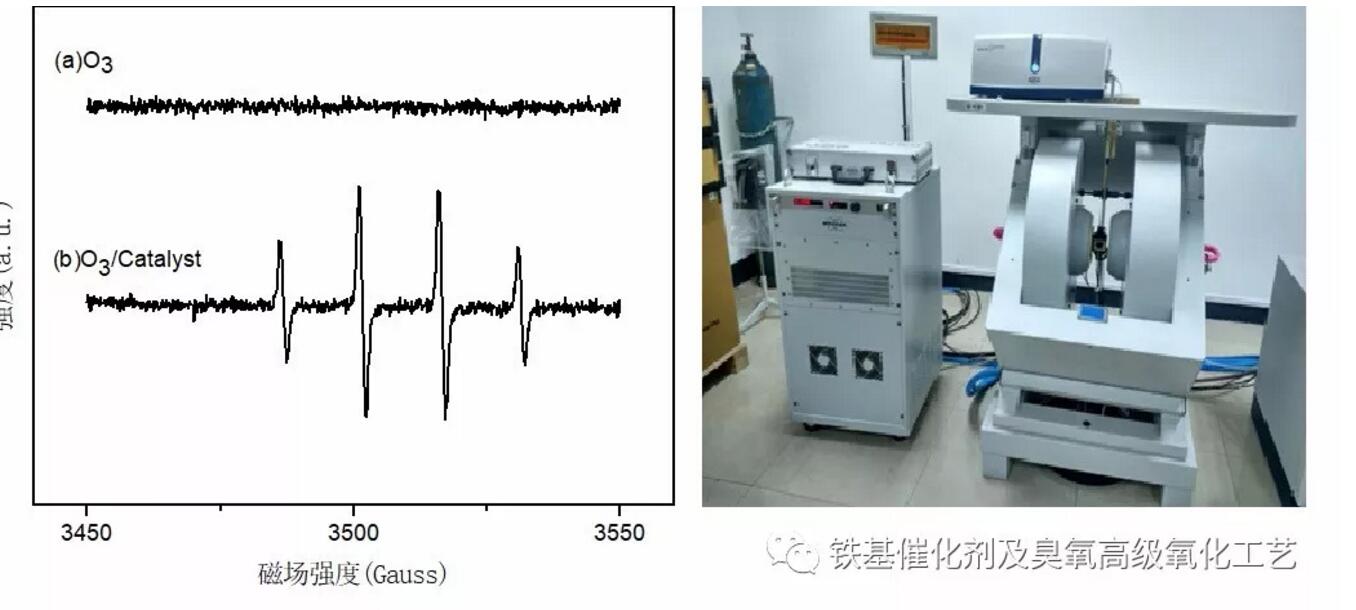

來源 馬魯銘老師 鐵基催化劑催化臭氧公賬號

